
目次

みなさんこんにちは!東大理系ライターのY.S.です!今回は私たちの身近な物質である食塩水について解説します!
意外と知らない食塩水のさまざまな性質や、それらを出発点とした化学の知識を身につけましょう!
そもそも、食塩水の化学式は何なのでしょうか?
食塩(=塩化ナトリウム)の化学式がNaCl、水の化学式がH2Oだということはご存知だと思います。では、水に食塩を溶かすと化学式はどうなるのでしょう?
結論から言うと、食塩水を1つの化学式で表すことはできません。食塩水は混合物だからです。
一般に、あらゆる物質は純物質と混合物のいずれかに分類することができます。
純物質は、1種類の物質のみからなる物質のことです。食塩や水は、いずれも他の物質と混ざり合っていない純粋な物質ですから、純物質となります。
対して混合物とは2種類以上の純物質を混ぜ合わせた物質で、1つの化学式で表すことができません。食塩水も食塩と水という2種類の純物質を混ぜ合わせた混合物なのです!
純物質と混合物の例を他にも挙げておきましょう。窒素N2や酸素O2、二酸化炭素CO2はいずれも純物質です。一方で空気は、これらを含む数種類の気体を混ぜ合わせた混合物となります。
ちなみに、純物質はさらに単体と化合物に分類することができます。単体は1種類の元素からなる純物質、化合物は2種類以上の元素からなる純物質です。
先ほどの例で言えば、窒素は N 、酸素は O という1種類の元素からなる単体である一方、二酸化炭素は C と O という2種類の元素からなる化合物です。
さて、食塩水の化学式についてわかったところで、次は食塩水のさまざまな性質を見ていきましょう!
「そもそも、食塩が水に溶ける仕組みって何?」「食塩水を電気分解するとどうなるの?」「食塩水は0°Cでも凍らないって本当?」といった疑問にお答えします!
食塩水の性質を知ることで、食塩水以外にも当てはまる化学の知識も身につけられるので、ぜひ最後まで読んでみてください!
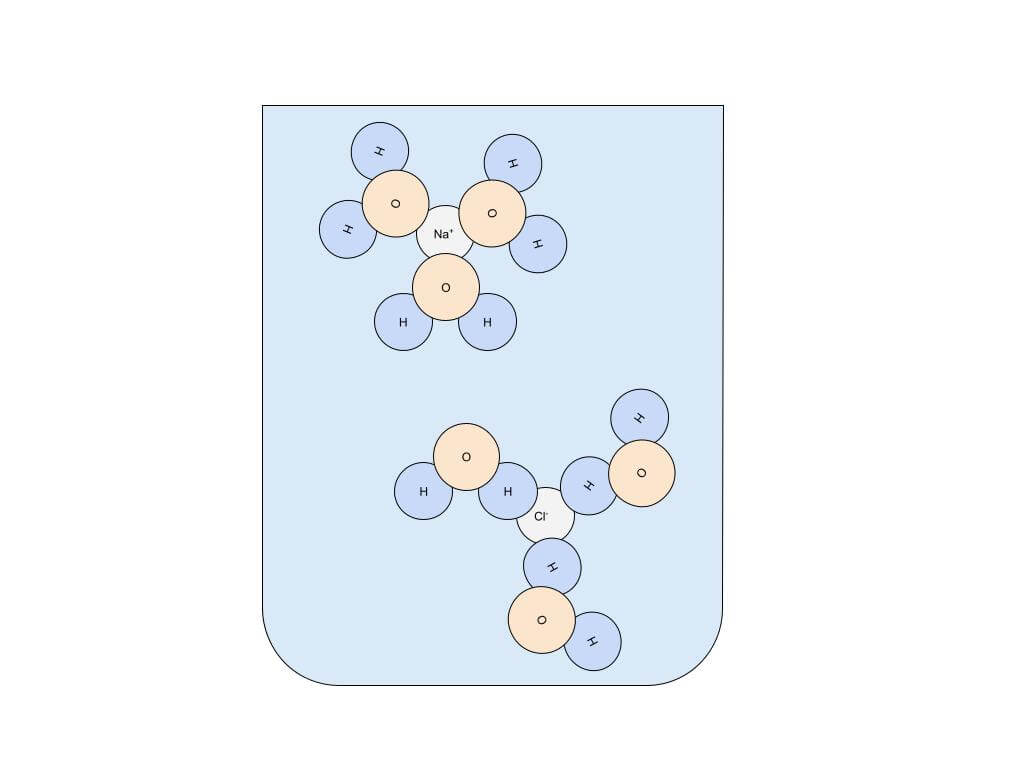
「食塩が水に溶ける」と当たり前のように言ってきましたが、そもそもそれはどんな仕組みなのでしょうか。水の中に入れると、食塩NaClはナトリウムイオンNa+と塩化物イオンCl–に分かれます。これを電離と呼びます。
ところで、電気陰性度という用語は知っていますか?知らなかった人は大雑把に「電気陰性度が大きいほど負に帯電しやすい」と思っておいてください。詳しくは化学基礎の最初の方で習います。
水 H2O で考えると、H よりも O の方が電気陰性度が大きいため、 H2O 中の H 原子は正・ O 原子は負の電気を帯びます。
つまり、水分子は1つの分子内に正に帯電した部分と負に帯電した部分を持つのです!
よって、水分子中のH原子と塩化物イオン、O原子とナトリウムイオンがそれぞれ引き合うことになるので、各イオンは水分子に囲まれて水中に分散し、「食塩が水に溶けた」ということになります。この現象を、水和と呼びます。
続いて、食塩水を電気分解するとどうなるのか考えてみましょう。
まず陽極側からです。陽極側では、水溶液中の塩化物イオンから極板へと電子が受け渡されます。電子を失った塩化物イオンは、気体の塩素Cl2となって発生します。
2Cl– → Cl2 + 2e–
では、陰極側ではどうなるのでしょう?陰極では、極板から水溶液側に電子が移動します。
「ナトリウムイオンが電子を受け取って、単体のナトリウムができるのでは?」と思った人もいるでしょう。しかし実際は、ナトリウムは生成せず、陰極側からは水素が発生します。
その理由は、金属のイオン化傾向にあります。金属はその種類によって、陽イオンへのなりやすさ(イオン化傾向)が異なります。つまり、イオン化傾向が大きいほど陽イオンの状態で安定ということになります。
金属のイオン化傾向の大小は、便宜的にH2を含めると以下のような順番です。
Li > K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > H2 > Cu > Hg > Ag > Pt > Au
この順から分かるように、ナトリウムは水素よりもイオン化傾向が大きいため、ナトリウムイオンではなく水が電子を受け取って水素が発生します。
イオン反応式は次の通りです。
2H2O + 2e− → H2 + 2OH−
みなさんの中には、食塩水を使ってアイスを冷やした経験のある人もいるかもしれません。実は、食塩水の凝固点は0°Cよりも低くなっているので、このような活用方法ができるのです。次は、この現象が起きる理由を解説していきます。
下の図を見てください。ざっくりと説明すると、食塩水ではナトリウムイオンと塩化物イオンが溶けていることによって、水の凝固が妨げられます。その結果、同じ0°Cでも純水は凝固するが、食塩水は凝固しないという違いが生じるのです。
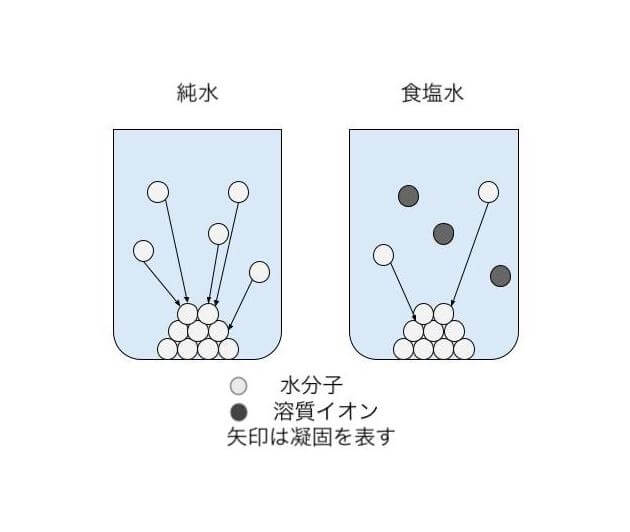
このようなメカニズムで、純溶媒よりも溶液の方が凝固点が低くなる現象を凝固点降下といいます。もちろん、食塩水以外の溶液でも起こる現象です。
今回は食塩水の性質をテーマに、物質の分類や水和、電気分解、凝固点降下などの解説をしました!意外と知らないことがあった人もいるのではないでしょうか?
スタディコーチ(studycoach)の公式LINEアカウントでは、受験や勉強にお得な情報を発信中です! 各種イベント・お得なキャンペーンのお知らせを受け取ることもできるので、ぜひ友達登録よろしくお願いします!
また本コラムでは「東大化学の勉強法」や「共通テスト化学の対策」なども解説しているので、ぜひこれらの記事もご覧ください!

スタディコーチ(studycoach)は現役東大生・早慶生のみが質の高い授業を行っており、高い指導実績と満足度を誇る個別指導塾です!
など、充実したサービスについてもっと知りたい方は、TOPページをご覧ください!TOPページを覗く

Y.S.
東大理科一類1年。受験生に近い視点から、さまざまな情報をお届けします!